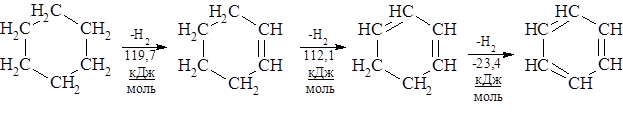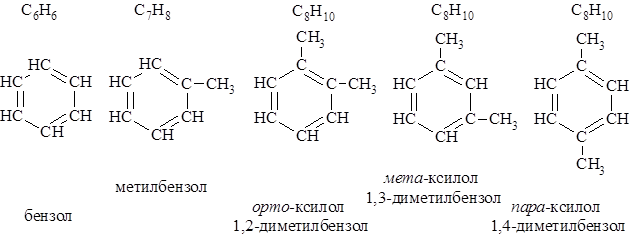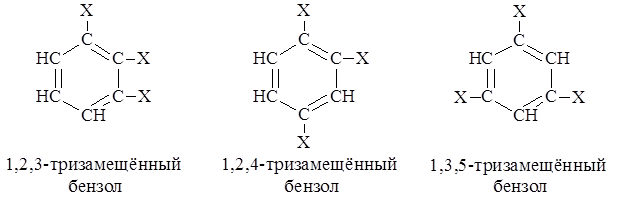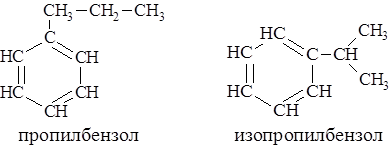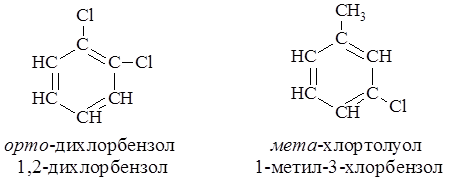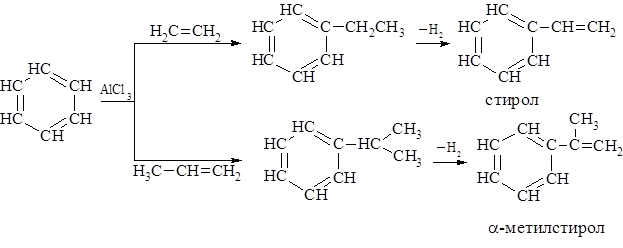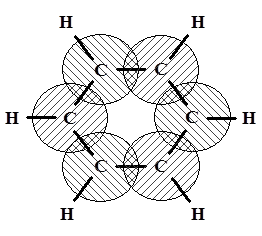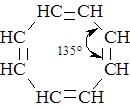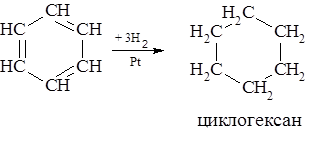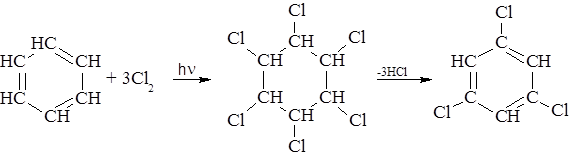ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Источники ароматических соединений 12
ТЕМА ЛЕКЦИИ: АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ) Вопросы: Общая характеристика: строение, классификация, номенклатура. Методы получения Физические свойства Химические свойства Отдельные представители. Способы идентификации. Общая характеристика: строение, классификация, номенклатура, изомерия
Ароматические углеводороды представляют собой большую группу веществ, содержащих в своей структуре чаще всего бензольный цикл или систему нескольких бензольных циклов. Общая формула бензола СпН2п-6 При дегидрировании циклогексана до циклогексена, циклогексадиена и циклогексатриена (бензола) первые две стадии эндотермичны, а стадия дегидрирования циклогексадиена с образованием бензола протекает с выделением энергии, что указывает на необычайно высокую энергетическую устойчивость бензола по отношению к другим участникам реакции и обуславливает специфические химические и физические свойства соединения, его так называемый ароматичеcкий характер.
Ароматический ряд объединяет соединения различных классов: углеводороды, галоген-, гидроксил-, карбонилпроизводные, карбоновые кислоты, амины и т.д. Вещества всех этих классов являются производными ароматических углеводородов.
Изомерия и номенклатура Первый член ряда углеводородов с одним бензольным циклом – бензол, второй – метилбензол или толуол. Третий член ряда – ксилол – имеет три структурных изомера: орто-, мета- и пара-.
Изомерия производных бензола зависит как от величины и числа заместителей, так и от их относительного расположения. Так, при одинаковых заместителях бензол и однозамещённый бензол не имеют изомеров, ди- и тризамещённый – имеют по три изомера.
Если заместители разные, число изомеров, начиная с тризамещённого бензола резко возрастает. Кроме того, источником изомерии может явиться сам заместитель.
Номенклатура Для названия углеводородов ароматического ряда и их производных применяются тривиальная, радикально-функциональная и ИЮПАК номенклатуры. В радикально-функциональной номенклатуре, используются названия следующих радикалов:
В номенклатуре ИЮПАК перед названием углеводорода проставляются названия заместителей с номерами углеродных атомов, которые несут эти заместители. Например:
При двух заместителях в бензольном цикле их взаимное расположение в цикле может обозначается не только цифрами (счет идет по кратчайшему пути от одного к другому), но и с помощью приставок орто-, мета-, пара-, обозначающих соответственно 1,2-, 1,3- и 1,4- относительные положения. Источники ароматических соединений Основными источниками ароматических соединений являются каменноугольная смола, нефть, ацетилен и некоторые эфирные масла. Каменноугольная смола получается при коксовании угля. Основными продуктами коксования являются коксовый газ, каменноугольная смола и кокс. По выходе из коксовой батареи газы коксования промываются водой. При этом поглощается аммиак и конденсируются продукты, составляющие каменноугольную смолу. Несконденсированные ароматические углеводороды адсорбируются затем тяжёлым поглотительным маслом и выделяются. Каменноугольную смолу разделяют перегонкой на 5 фракций: углеводородную, фенольную, нафталиновую, антраценовую и пёк. Для выделения индивидуальных соединений каждую фракцию разгоняют дополнительно. Выход смолы ~ 3 %, но при современных масштабах коксового производства промышленность получает огромное количество ароматического сырья.
Содержание ароматических углеводородов в нефти колеблется примерно от 20 до 40%. Поэтому нефть является важным поставщиком бензола и его производных. Кроме того, ароматические углеводороды образуются при деструктивной переработке нефти. Процесс ароматизации нефти, который называют риформингом, протекает при температуре ~ 500 °С, давлении 15-40 ат на платиновом катализаторе (Pt/Al2O3). При этом углеводороды нефти подвергаются дегидроциклизации, дегидрированию, частичной дециклизации с образованием ароматических углеводородов.
Методы получения – Ацетилен превращается в бензол при значительном нагревании и воздействии активированного угля как катализатора.
– Наиболее распространённым способом синтеза гомологов бензола являетсяреакция алкилирования бензола галогеналканами, спиртами или олефинами в присутствии катализаторов (например, галогениды алюминия).
Алкилированием бензола этиленом и пропиленом получают этилбензол и изопропилбензол.
Дегидрирование этих продуктов даёт стирол и α-метилстирол – ценные мономеры для получения синтетического каучука и полимерных материалов.
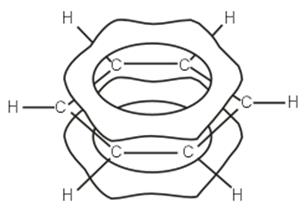
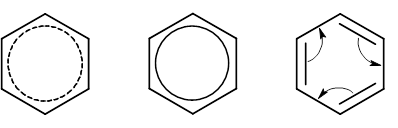
Строение молекулы бензола В 1865 г. Август Кекуле (Боннский университет) предложил формулу бензола с чередующимися двойными связями, которая использовалась до сих пор и в некоторых случаях будет использоваться далее. Эта формула находится в согласии со многими свойствами бензола: цикличностью структуры, равноценностью всех углеродных и водородных атомов, возможностью присоединения. Она объяснила существование лишь одного монозамещённого и трёх изомеров (орто-, мета- и пара-) дизамещённого бензола. Однако бензол более склонен к реакциям замещения, нежели присоединения, бензольное кольцо устойчиво к окислителям, хотя по формуле в нём три двойные связи. Бензол не дает реакций с бромной водой и раствором перманганата калия, характерных для непредельных соединений. Все эти факты формула Кекуле объяснить не могла. Решающую роль в установлении строения бензола сыграли физические методы исследования вещества, преимущественно разработанные в прошлом веке. Молекула бензола неполярна. Бензол имеет ось симметрии 6-го порядка. Это означает, что ядра и электроны в нём расположены совершенно симметрично. На основании рентгено- и электронограмм было установлено, что молекула бензола плоская и расстояния между центрами углеродных атомов одинаковы и равны 0,139 нм. Это почти средняя величина между длинами простой (0,154 нм) и двойной (0,134 нм) связей. Весьма интересные сведения дают термодинамические исследования. Например, образование двойной связи из простой С–С-связи, как это было показано в начале лекции, требует затраты энергии. В то же время дегидрирование 1,3-циклогексадиена с образованием бензола идет с выделением тепла. Все эти физические и химические особенности строения и свойств бензола объяснимы с точки зрения современных представлений о строении бензола. Шесть углеродных атомов бензола находятся в состоянии sр2-гибридизации. Оси всех sр2-орбит лежат в одной плоскости под углом 120 ° друг к другу. Перекрывание электронных sр2-облаков соседних атомов углерода создает σ-связи С–С. Все шесть σ-связей С–С одинаковы, лежат в одной плоскости. Молекула бензола, в которой углы между связями составляют 120°, не напряжена. Оси негибридизованных р-электронов шести атомов углерода перпендикулярны плоскости кольца. При боковом перекрывании р-орбиталей образуется круговая молекулярная электронная орбита, по которой свободно, не связываясь с каким-либо атомом двигаются электроны.
.При этом достигается почти идеально равномерное распределение электронной плотности в системе сопряжения, которое приводит к энергетической стабилизации молекулы бензола на ~150 кДж∙моль-1 и появлению необычных свойств, совокупность которых объединяется термином «ароматичность». Ароматичность не имеет непосредственного отношения к запаху органических соединений. Термин «ароматичность» был предложен потому, что первые представители этого класса веществ обладали приятным запахом. Наиболее важными признаками ароматичности являются повышенная устойчивость ненасыщенной циклической структуры и большая склонность ароматических соединений к реакциям замещения, сохраняющим стабилизирующую их систему сопряженных связей в цикле, а не к реакциям присоединения, разрушающим эту систему и дестабилизирующему молекулу. Необходимым условием сопряжения в ароматических системах является параллельность осей всех р-электроных орбиталей. Циклооктатетраен, например, лишён ароматических свойств поскольку из-за большого углового напряжения при угле 135 ° между связями (вместо 120°характерных для sр2 –гибридизации) он не может сохранить плоской структуры, и оси р-орбиталей не параллельны.
Существуют несколько критериев, объединенных правилом Хюккеля, по которым молекула может быть отнесена к ароматической: для того, чтобы соединение было ароматическим, в его молекуле должна содержаться циклическая система делокализованных p-электронов выше или ниже плоскости молекулы; облако p-электронов должно насчитывать (4n+2) p-электронов. Здесь n– любое целое число (0, 1, 2, 3, 4, ….) Ароматические соединения встречаются в различных классах органических веществ. Для изображения бензольного кольца используют формулы нескольких видов.
Формула Кекуле используется условно, в основном для написания уравнений реакций присоединения.
Физические свойства Ароматические углеводороды бензольного ряда – это жидкие и твердые вещества, обладающие сильным запахом. Температура кипения бензола (C6H6) – 80,1°C выше температуры кипения гексана (C6H14) – 68,8 °C. Температуры кипения изомерных соединений различаются мало. Бензольные углеводороды практически не растворимы в воде.
Химические свойства Для ароматических углеводородов характерны реакции присоединения и замещения. Причем наибольшая склонность к реакциям замещения. Реакции присоединения, характеризующие бензол как ненасыщенное соединение. – Водород присоединяется к ароматическим углеводородам только в присутствии катализатора и при повышенной температуре.
– Под влиянием жесткого ультрафиолетового облучения бензол присоединяет хлор и бром с образованием гексагалогенциклогексана, который при нагревании переходит в тригалогенбензол.
– Подобно другим ненасыщенным углеводородам бензол озонируется с образованием сильного взрывчатого вещества – триозонида бензола.
Под действием воды триозонид даёт три молекулы глиоксаля. Эта реакция используется для установления строения соединений. Все эти превращения характеризуют бензол как ненасыщенное соединение.
12 |