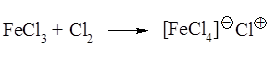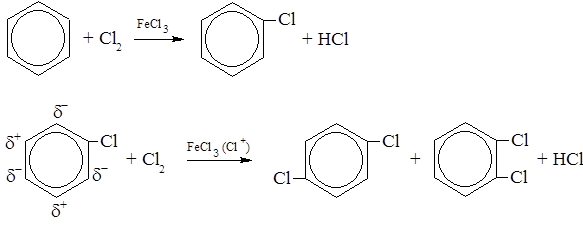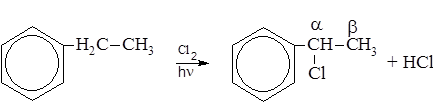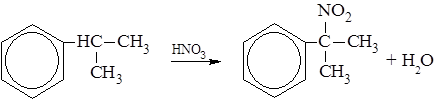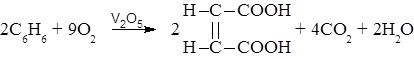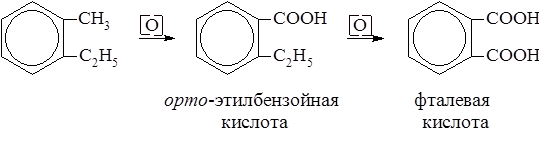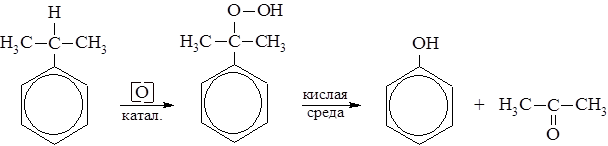ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Правила замещения в бензольном цикле 12
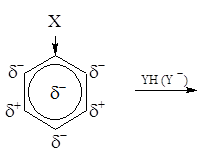
Если в незамещенном бензоле электронная плотность в кольце распределена равномерно, то в замещенном бензоле С6Н5Х под влиянием заместителя Х происходит перераспределение электронов и возникают области повышенной и пониженной электронной плотности. Это оказывает влияние на легкость и место вступления нового заместителя. Поскольку атакующая ядро группа прежде всего взаимодействует с отрицательно заряженной электронной системой сопряжения бензольного ядра, реакции замещения в ароматическом цикле должны протекать по ионному механизму с участие заряженных атакующих частиц. Реакционная способностьтого или иного атома углерода в кольце определяется следующими факторами: – положением и природой уже имеющихся заместителей; – природой новой замещающей (атакующей) группы; – условиями проведения реакции. Первые два фактора наиболее значимы.
Заместители в бензольном кольце делятся на две группы: Заместители CH3, CH2R, CHR2, CR3, OH, OR, NH2, NHR, NR2, F, Cl, Br, I и другиеназываются заместителями первого рода.Они способны отдавать электроны– это электронодонорные заместители. Заместители второго родаспособны оттягивать на себя, принимать электроны. Это – электроноакцепторные заместители. К ним относятся SO3H, NO2, COOH, COOR, CHO, COR, CN, NH3+ и другие. В свою очередь, атакующие (замещающие) группы могут бытьэлектрофильнымиилинуклеофильными. Электрофильные реагенты в реакции служат акцепторами электронов. В частном случае – это катионы. Нуклеофильные реагенты в реакции являются донорами электронов. В частном случае – это анионы.
Если реагент действует на ядро с одним заместителем, то можно выделить несколько вариантов их взаимодействия: – Заместитель первого рода; реагент электрофильный. В качестве примера рассмотрим реакцию нитрования толуола нитрующей смесью (смесь азотной и серной кислот).
Метильная группа в толуоле является ориентантом первого рода. Это электронодонорная частица. Поэтому ядро в целом из-за смещения электронной плотности от метильной группы получает дробный отрицательный заряд. Ближайшие к заместителю атомы углерода цикла заряжаются также отрицательно. Последующие углероды цикла приобретают чередующиеся заряды (альтернирующий эффект). Реакция между азотной и серной кислотами нитрующей смеси дает несколько частиц, среди которых присутствует электрофильная частица NO2+ (на схеме показана над стрелкой в скобках), которая атакует отрицательно заряженные атомы цикла. Происходит замещение водородных атомов на нитрогруппу в орто- и пара-положениях относительно метильной группы. Поскольку ядро имеет отрицательный заряд, а атакующая частица электрофильна(заряжена положительно), реакция облегчается и может протекать в более мягких условиях по сравнению с нитрованием бензола. – Заместитель второго рода; реагент электрофильный.
Сульфогруппа (ориентант второго рода, электроноакцепторный) благодаря смещению электронной плотности к себе заряжает ядро в целом и ближайшие углероды ядра положительно. Атакующая частица электрофильна. Ориентация в мета-положение. Заместитель затрудняет действие реагента. Сульфирование следует проводить концентрированной серной кислотой при повышенной температуре. – Заместитель второго рода; реагент нуклеофильный.
В соответствии с зарядами нуклеофильная частица OK– атакует орто- и пара-положения и заместитель облегчает действие реагента. Тем не менее, реакции нуклеофильного замещения приходится проводить в довольно жестких условиях.Это объясняется энергетической невыгодностью переходного состояния в реакции и тем, что π-электронное облако молекулы отталкивает атакующую нуклеофильную частицу. – Заместитель первого рода; реагент нуклеофильный. Заместитель затрудняет действие реагента. Ориентация в мета-положение. Такие реакции практически не реализуются.
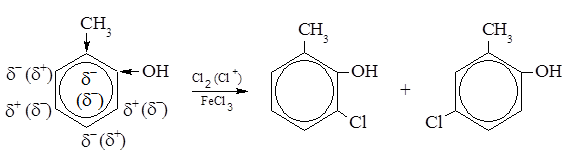
Если в ядре имеется несколько различных заместителей, то преимущественное направляющее действие оказывает тот из них, который обладает наибольшим ориентирующим действием. Например, в реакциях электрофильного замещения по силе ориентационного действия заместители можно расположить в следующий ряд: OH > NH2 > ОR > Cl > I > Br > CH3; Ориентирующая способность ориентантов второго рода убывает в следующей последовательности: NO2 > COOH > SO3H. В качестве примера приведена реакция хлорирования орто-крезола (1-гидрокси-2-метилбензола):
Оба заместителя – ориентанты первого рода, электронодонорные. Судя по зарядам на атомах углерода (в скобках – от группы –ОН), ориентация не совпадает. Поскольку фенольный гидроксил является более сильным ориентантом, в основном получаются продукты, соответствующие ориентации этой группы. Оба заместителя облегчают протекание реакции. Реакция электрофильная благодаря взаимодействию катализатора с молекулярным хлором.
На практике правила замещения чаще всего выполняются не строго. При замещении получаются все возможные продукты. Но продуктов, которые должны получаться по правилам, всегда больше. Например, при нитровании толуола образуется 62% орто-, 33,5% пара- и 4,5% мета-нитротолуолов. Изменение внешней среды (температура, давление, катализатор, растворитель и т. д.) обычно слабо влияет на ориентацию.
Ряд реакций замещения показан при объяснении правил ориентации. Рассмотрим еще несколько реакций. – При действии на бензол хлора или брома в присутствии катализаторов – переносчиков галоидов, например, FeCl3, AlCl3, SnCl4 и других происходит последовательное замещение атомов водорода при циклических углеродах на галоген.
В последней электрофильной реакции хлор как ориентант первого рода направляет второй атом хлора в орто- и пара- положения (преимущественно – в пара-). Однако, в отличие от других ориентантов первого рода он затрудняет реакцию из-за своих сильно выраженных электороноакцепторных свойств, заряжая ядро положительно. В момент атаки электрофильной частицы галоген исходного соединения возвращает часть электронной плотности ядру, создавая заряды на его углеродах, соответствующие действию ориентанта первого рода (динамический эффект ориентации). – Галогенировании алкилзамещенных бензола на свету протекает по радикальному механизму и замещение происходит у α-углеродного атома боковой цепи:
– При нитрование по Коновалову (разбавленный водный раствор азотной кислоты, ~140оС), протекающее по радикальному механизму, также приводит к замещению в боковой цепи:
– Окисление бензола и его гомологов. Бензольное кольцо окисляется очень трудно. Однако в присутствии катализатора V2O5 при 400-500оС бензол образует малеиновую кислоту.
Гомологи бензола при окислении дают ароматические кислоты. Причём боковая цепь даёт карбоксильную группу при ароматическом кольце, независимо от своей длины.
Подбором окислителей можно добиться последовательного окисления боковых цепей. В присутствии катализаторов из алкилбензолов образуются гидроперекиси, разложением которых получают фенол и соответствующие кетоны.
Отдельные представители Бензол – жидкость, tплав.= 5,4°С, tкип= 80,1°С, с водой образует азеотропную смесь, поэтому при перегонке легко обезвоживается. В промышленности имеет чрезвычайно широкое применение: как растворитель, для получения производных бензола и других соединений (хлорпроизводных, анилина, фенола, красителей, взрывчатых веществ, лечебных препаратов, капрона, нейлона, ацетона, полистирола и т.д.). Толуол – жидкость, tплав.= -93°С, tкип= 110,6°С. Главное применение – производство взрывчатых веществ (тротил: тринитро-толуол), бензойного альдегида, хлористого бензила, которые служат сырьем для анилинокрасочной, парфюмерной, пищевой и других отраслей промышленности. Используется как растворитель. Ксилолы. Смесь ксилолов используется как растворитель и для повышения октанового числа моторных топлив (ОЧ ≥ 120). Большое количество пара-ксилола идет на производство синтетического волокона лавсан. Получают ксилолы главным образом риформингом узких нефтяных фракций с пределами выкипания близкими к температуре кипения ксилолов. Этилбензол. Получают алкилированием бензола этиленом в присутствии AlCl3. Используется в основном для получения стирола (винилбензола). Стирол. Ароматические углеводороды с двойными связями в боковой цепи в настоящее время используются очень широко. Стирол является простейшим представителем этого вида углеводородов. Это – жидкость с tкип = 146°С. Важнейший способ получения состоит в следующем:
Под действием катализаторов стирол полимеризуется в твёрдую полупрозрачную массу – полистирол.
(n ≤ 5000) Полистирол имеет высокое электросопротивление и влагостойкость. Полимеризацией стирола и дивинила получают синтетический каучук, пригодный для изготовления шинной резины. 12 |