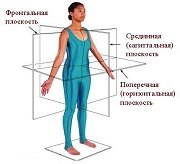
 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Определение содержания серной кислоты в растворе. 12
ЦЕЛЬ РАБОТЫ: Определить содержание H2SO4 в анализируемом образце.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ: Определение H2SO4 проводят прямым титрованием стандартным раствором щёлочи.
H2SO4 + 2 NaOH = Na2SO4 + 2Н2O
Проводится титрование сильной кислоты сильной щёлочью, рН в точке эквивалентности равно 7. Скачёк титрования находится в пределах рН от 4 до 10. В качестве индикатора можно использовать фенолфталеин, нейтральный красный, метиловый красный, метиловый оранжевый. Применение любого из перечисленных индикаторов приведёт к приблизительно одинаковому результату.
ПРИБОРЫ И РЕАКТИВЫ: 1. Контрольный раствор H2SO4. 2. Стандартный раствор NaОН. 3. Индикаторы. 4. Дистиллированная вода. 5. Пипетка на 10 см3. 6. Бюретка на 25 см3. 7. Колба для титрования.
ХОД РАБОТЫ: Выданный преподавателем раствор H2SO4 в мерной колбе на 100 см3 доводят до метки, тщательно перемешивают. Затем в колбу для титрования переносят пипеткой точный объём контрольного раствора H2SO4 (10 см3), прибавляют 1-2 капли индикатора и титруют раствором щёлочи до изменения окраски индикатора.
Объём щёлочи, пошедший на титрование V 1(NaOH) = V 2(NaOH) = V 3(NaOH) =
Vср(NaOH) =
РАСЧЁТ РЕЗУЛЬТАТОВ АНАЛИЗА:
C (1/2H2SO4)=
Т( H2SO4) =
m (H2SO4)практ. = T (H2SO4) · Vколбы
РАСЧЕТ ОТНОСИТЕЛЬНОЙ ПОГРЕШНОСТИ:
∆ =
ЛАБОРАТОРНАЯ РАБОТА № 13 Определение Na2CO3 в контрольном растворе ЦЕЛЬ РАБОТЫ: Определить массу карбоната натрия в анализируемом образце.
ЗАДАНИЕ: Рассчитать рН раствора в 1 -й и 2 -й точках эквивалентности. Обосновать выбор индикатора. Определить содержание Na2СО3 в растворе.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ: Карбонат-ион в одном растворе является слабым анионным основанием, протонирующимся по двум ступеням:
СО32- + Н2O – НСО3- + ОН- рК1 = 6,37
НСO3- +Н2O = Н2СO3 + ОН- рК2= 10,25
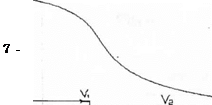
Отношение Kl : К2 ⋍ 104, следовательно кривая титрования будет характеризоваться двумя точками рН и Na2CO3 можно оттитровать как до NаНСО3, так и до Н2СО3. Na2CO3 + НСl = NaHCO3 + NaCl fэкв (Na2CO3) = 1 Na2CO3 + 2 HCl = 2 NaCl + H2CO3 fэкв (Na2CO3) = 1/2 Кривая титрования Na2CO3. 1. Исходная точка Na2CO3 pH = 7 + 2. Первая точка эквивалентности. Оттитрованная половина Na2CO3
рН = рН(1) в т.э = 8,35 Индикатор фенолфталеин.
3.Вторая точка эквивалентности. Оттитрован весь Na2СО3. В растворе есть Н2СO3
рН = рН(2) в т.э. = 3,85
Н2СО3 является слабой кислотой, поэтому константа диссоциации берётся по первой ступени. рКк1 = 6,37 Индикатор метиловый оранжевый. Кривая титрования раствора Na2CO3 Na2CO3 → 2Na+ + СO32- СO32- + Н+=НСO3- НСO3-+Н+=Н2СO3
ПРИБОРЫ И РЕАКТИВЫ: 1 .Колба для титрования. 2. Мерная колба. 3. Бюретка, пипетка. 4. Индикаторы метиловый оранжевый и фенолфталеин. 5. Раствор Nа2СО3 0,1н, приготовленный из фиксанала. 6. Устанавливаем раствор НС1 ≈ 0,1н
ХОД РАБОТЫ: Полученный раствор Na2CO3 в мерной колбе доводят до метки дистиллированной водой и тщательно перемешивают. Отбирают из колбы аликвотную часть раствора Na2CO3, переносят в колбу для титрования, добавляют 2 капли раствора фенолфталеина и тируют раствором НСl до слабо розовой окраски. Титрование ведут медленно при непрерывном перемешивании титруемого раствора во избежание высоких локальных концентраций НСl, обуславливающих образование СО2 (NaHCO3 + НСl), и, следовательно, завышенного результата анализа. Записывают объёмV1. Затем в эту же колбу добавляют 2 капли метилового оранжевого и дотитровывают раствор до золотисто-оранжевого цвета (метод свидетелей). Записывают объём V2. V2 должен быть примерно равен 2V1. По результатам 5-7 титрований находят среднее значение V(нcl) и рассчитывают содержание Na2CO3 в колбе. ПРОТОКОЛ АНАЛИЗА: Объём раствора НСl, пошедший на титрование VI = VI = Vlcp. = VI = V2 = V2 = V2 =
V2 ср. =
РАСЧЕТ РЕЗУЛЬТАТОВ АНАЛИЗА:
РАСЧЕТ ОТНОСИТЕЛЬНОЙ ПОГРЕШНОСТИ:
∆ =
12 |


 2
2 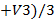
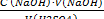
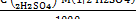
 · 100%
· 100%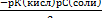

 pH
pH


 VHCl
VHCl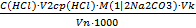
 · 100%
· 100%