ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Дифференциальная диагностика
Дифференциальную диагностику проводят с другими гипербилирубинемиями (синдромами Криглера-Найяра, Жильбера, Ротора; см. рис. 8-10), вирусным гепатитом, ХГ, проявляющимся холестатическим синдромом, механической желтухой, первичным билиарным циррозом.
Лечение
Больные должны стараться соблюдать щадящий режим - избегать провоцирующих факторов: инфекций, физических и психических нагрузок, инсоляции, употребления гепатотоксичных препаратов, алкоголя. Требуются санация хронических очагов инфекции и лечение имеющейся патологии желчевыводящих путей. Рекомендуют диету с ограничением тугоплавких жиров и продуктов, содержащих консерванты. Медикаментозного лечения не существует, хотя в определенной степени повышенный уровень билирубина поддается коррекции фенобарбиталом. Рекомендуются витамины группы В, желчегонные средства. Критерии эффективности лечения - уменьшение интенсивности или устранение желтухи, нормализация (достоверное уменьшение) уровня билирубина в крови. Продолжительность лечения - в течение всей жизни. Прогноз
Прогноз благоприятный. Заболевание не влияет на продолжительность жизни пациентов.
Синдром Ротора Код по МКБ-10 E80.6. Синдром Ротора.
Синдром Ротора - наследственный пигментный гепатоз с аутосомно-рецессивным типом наследования, напоминающий синдром Дабина-Джонсона, однако дефект экскреции билирубина менее выражен. Описал филиппинский терапевт A.B. Rotor в 1948 г. Синдром Ротора - очень редкое состояние, первичный биохимический дефект, в отличие от других функциональных гипербилирубинемий, не идентифицирован. Как правило, заболевание возникает в детском возрасте. Клиническая картина
Клиника проявляется интермиттирующей желтухой, нарастанием билирубина, повышением содержания копропорфирина в моче, задержкой бромсульфалеина. Желчный пузырь в данном случае контрастируется. У большинства болезнь протекает бессимптомно.
Диагностика
Наследственный синдром Ротора характеризуют следующие признаки: • умеренное повышение в крови прямого (связанного) билирубина вследствие нарушения механизмов его транспорта из микросом гепатоцитов в желчь; • неизмененная активность печеночных ферментов; • повышенное выделение с мочой желчных пигментов; • отсутствие темно-коричневого пигмента в гепатоцитах при пункционной биопсии; • признаки жировой дистрофии гепатоцитов; • визуализация желчного пузыря при холецистографии.
Дифференциальная диагностика
Алгоритм дифференциальной диагностики желтух представлен на рис. 8-10. Лечение включает щадящий режим, исключение применения препаратов - конкурентов глюкуронирования или вытесняющих билирубин из связи с альбумином (сульфаниламидов, гепарина, салицилатов, оральных контрацептивов). Рекомендуют диету с ограничением тугоплавких жиров и продуктов, содержащих консерванты, с достаточной водной нагрузкой. Противопоказана инсоляция. Показаны санация хронических очагов инфекции и лечение имеющейся патологии желчевыводящих путей.
Прогноз
Прогноз благоприятный.
Недостаточность α-1-антитрипсина Коды по МКБ-10 Q34.8. Врожденные аномалии органов дыхания. Q44.7. Врожденные аномалии органов печени.
Недостаточность α-1-антитрипсина - генетический дефект гликопротеина, ингибирующего активность протеолитических ферментов: трипсина, химотрипсина и эластазы, который может вызвать заболевания легких у взрослых и заболевания печени у взрослых и детей. Это наиболее распространенное генетическое заболевание печени, определяемое у младенцев. Впервые дефицит α-1-антитрипсина был описан в 1963 г. При недостаточности а1-антитрипсина частота гомозиготного носительства составляет 1:600, гетерозиготного носительства - 1:2500. Около 1-3% взрослых больных с диагнозом «хроническая обструктивная болезнь легких» имеют недостаточность а1-антитрипсина.
Этиология и патогенез
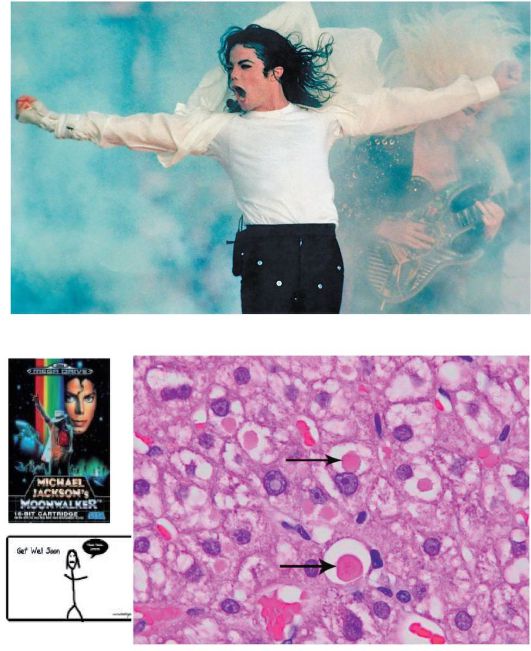
α-1-Антитрипсин - сывороточный ингибитор сериновых протеаз, образующийся в печени. Формы α-1-антитрипсина детерминированы генетически. Около 90% здорового населения имеют генотип PiMM. У больных имеется генотип PiZZ, при котором α-1-антитрипсин не секретируется в кровь из гепатоцитов, так как полимеризуется в эндоплазматическом ретикулуме гепатоцитов. В мутантных вариантах синтезируемого белка ему не хватает возможностей для перехода с эндоплазматического ретикулума в зону Гольджи, и, следовательно, α1-антитрипсин накапливается в эндоплазме, как гиалиновые шарики (рис. 8-12). У лиц, гомозиготных по данному аллелю (PiZZ), активность α-1-антитрипсина в крови особенно низка, возможно развитие поражения легких и печени.
Клиническая картина
У детей с генотипом PiZZ заболевание может проявиться на первом году жизни: развивается тяжелая паренхиматозная желтуха, в дальнейшем - печеночно-клеточная недостаточность, быстро наступает летальный исход. Другой вариант поражения печени при недостаточности α-1-антитрипсина - длительно сохраняющаяся желтуха в первые недели жизни, обычно расцениваемая как неонатальный холестаз. В последующем развивается гепатоспленомегалия, однако даже при сформировавшемся циррозе печени дети могут чувствовать себя удовлетворительно.
Основные проявления касаются начала эмфиземы легких в возрасте от 20 до 50 лет. Медленно прогрессирующая одышка - основной симптом, хотя многие пациенты изначально имеют кашель с выделением мокроты или свистящее дыхание, а также потерю массы тела. Курение или воздействия табачного дыма ускоряет появление симптомов и заболевания легких. Около 10% детей и 15% взрослых имеют повреждения печени, ведущие к циррозу печени. Признаки заболевания печени могут включать отеки нижних конечностей, желтуху и иктеричность склер, запор. В пубертатном периоде возможно развитие хронического АИГ и цирроза печени с гепатомегалией, портальной гипертензией, гиперспленизмом, печеночной энцефалопатией. В редких случаях дефицит α-1-антитрипсина вызывает поражение кожных покровов. Пример заболевания и смертельного исхода - легендарный поп-певец Майкл Джексон (см. рис. 8-12).
Рис. 8-12. Цирроз печени. Накопление α-1-антитрипсина в эндоплазме, подобно гиалиновым шарикам (указаны стрелками; окраска гематоксилин-эозином; х250). Фото и рисунок Майкла Джексона
Диагностика
Важны анамнестические данные о длительности желтухи или гепатита новорожденных, эмфиземы в юношеском возрасте. На электрофореграмме белков в сыворотке крови: отсутствие α-1-глобулинов, в сыворотке крови снижена активность α-1-антитрипсина. Индикатор повреждения печени - повышение ЩФ. В генетическом анализе обнаруживают генотип PiZZ.
Патоморфология
В биоптатах печени: ШИК-положительные включения в перипортальных гепатоцитах, содержащие α-1-антитрипсин (см. рис. 8-12). |