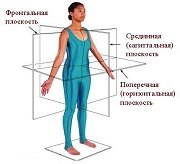
 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Диаминомонокарбоновые аминокислоты
Лизин (a, e-диаминокапроновая кислота) a Н2С–(СН2)3–СН–СООН | | NH2 NH2 Содержится почти во всех белках, особенно много в белках молок рыб, относящихся к протаминам и гистонам. Является исходным продуктом для синтеза алкалоидов (анабазин, никотин, лупанин, кониин). Своей e-аминогруппой участвует в образовании комплекса между белковой частью фермента и коферментом, например, в биотинзависимых ферментах. В белках семян злаковых, особенно кукурузы, содержится в незначительных количествах, что существенно обесценивает их кормовые свойства. Применяется в качестве кормовой добавки для восполнения дефицита этой аминокислоты в растительных белках. Аргинин (a-амино-d-гуанидил-n-валериановая кислота) a H2N–C–NH–(CH2)3–CH–COOH || | NH NH2 Играет большую роль в белковом обмене, участвуя в синтезе мочевины и креатина. В виде фосфоаргинина (в мышцах беспозвоночных) выполняет функцию, аналогичную функции фосфокреатина высших животных. В большом количестве входит в состав основных белков гистонов и протаминов, поэтому его много в белках рыбьих молок. Моноаминодикарбоновые аминокислоты Аспарагиновая кислота (a-аминоянтарная кислота) a НООС–СН2–СН–СООН | NH2 Плохо растворима в воде, ее раствор имеет кислую реакцию. Содержится в больших количествах во всех растительных белках и играет важную роль в обмене веществ у растений и животных, в частности, принимая участие в реакциях переаминирования, образовании мочевины, креатина, циклопептидов. При ее декарбоксилировании образуется a- или b-аланин, необходимый для синтеза карнозина, ансерина и коэнзима А (КоА). Амид аспарагиновой кислоты – аспарагин накапливается в очень больших количествах при прорастании семян бобовых растений, особенно в темноте, из-за отсутствия углеводов или избытка аммиака. Аспарагин обнаружен в плазме крови и в составе некоторых животных белков (инсулин, гемоглобин, мпиоглобин и др.). У человека и животных аспарагин, как и аспарагиновая кислота, активно участвует в реакциях переаминирования, служит предшественником при синтезе пуриновых и пиримидиновых оснований, никотиновой кислоты, у растений является запасной и транспортной формой азота. Глутаминовая кислота (a-аминоглутаровая кислота). a НООС–СН2 –СН2–СН–СООН | NH2 Плохо растворима в воде, в водных растворах дает кислую реакцию. Входит в состав фолиевой кислоты, глутатиона. Наряду с аспаргиновой кислотой играет важную роль в аминокислотном обмене, активно участвуя в реакциях переаминирования, дезаминирования, прямого аминирования. При декарбоксилировании глутаминовой кислоты образуются g-амино-масляная кислота, имеющая большое значение в метаболизме мозга (в частности, усиливающая процессы торможения), и d-аминолевулиновая кислота, участвующая в синтезе порфиринов. Амид глутаминовой кислоты – глутамин – является транспортной формой азота у животных и растений, исходным соединением при синтезе пуриновых и пиримидиновых оснований, никотиновой кислоты. Мононатриевая соль глутаминовой кислоты служит вкусовой приправой, обладая вкусом и запахом куриного бульона. Применяется в пищевой промышленности (в виде Na-соли) для улучшения вкуса и пищевой ценности продуктов, а также в медицине для лечения некоторых психических и нервных заболеваний (в виде Mg- или Диаминодикарбоновые аминокислоты Цистин (дицистеин, a, a¢-диамино-b, b¢-дитиопропионовая кислота, 3,3¢-дитио-бис-2-аминопропионовая кислота). Образуется из двух молекул цистеина за счет дисульфидной сшивки Плохо растворим в воде, не растворим в эфире. Входит в состав многих белков и природных пептидов. Особенно высоко содержание цистина в кератине. Циклические аминокислоты Фенилаланин (a-амино-b-фенилпропионовая кислота) a
|
Незаменимая аминокислота, входит в состав белков. Участвует в биосинтезе флавоноидов, алкалоидов. Обладает способностью к гидрофобным взаимодействиям. Обусловливает ксантопротеиновую реакцию на белки. Входит в состав грамицидина и тироцидина. Тирозин (a-амино-b-парагидроксифенилпропионовая кислота) a
|
| OH
Является исходным субстратом для синтеза гормонов (тироксин, норадреналин, адреналин) и алкалоидов (морфин, кодеин, папаверин). Окисление тирозина под влиянием тирозиназы приводит к образованию меланинов (входят в состав пигмент кожи, волос, перьев).
Триптофан (a-амино-b-индолилпропионовая кислота)
NH2
N ½ H Незаменимая аминокислота, входит в состав белков, дает главный вклад в их УФ-спектры и флуоресценцию. При кислотном гидролизе белков распадается. Триптофан служит исходным продуктом для синтеза никотиновой кислоты (витамин Р) и гетероауксина. Семена злаков бедны триптофаном. Гистидин (a-амино-b-имидазолпропионовая кислота)
b a
| NH2 N ½ H Принадлежит к группе основных аминокислот, в водных растворах дает щелочную реакцию. Значительное количество гистидина содержится в глобине – белковом компоненте гемоглобина крови. Входит в активные центры некоторых протеолитических ферментов. Гистамин является биогенным амином. Вызывает расширение капилляров и повышение ин проницаемости, сужение крупных сосудов, сокращение гладкой мускулатуры. Резко усиливает секркцию соляной кислоты в желудке. Используется в медицине. Гистидин при декарбоксилировании образует гистамин, который является биогенным амином. При любой аллергической реакуции организма содержание гистамина повышается. Для нормализации используются антигистаминные препараты. Гистамин входит в состав мышечной ткани рыб с окрашенным мясом (скумбрия, тунец и др.). Пролин (пирролидин-2-карбоновая кислота, пирролидин-a-карбоновая кислота)
H2C CH–COOH N ½ Н
Является иминокислотой. Хорошо растворим в спирте. Характерен для растительных белков (проламины), особенно велико содержание пролина в белках семян злаков, в коллагене, эластине и белке эмали зубов. Входит в состав ряда антибиотиков-циклопептидов – грамицидина, лихениформина, актиномицина Д. Оксипролин (4-гидрокси-2-пирролидинкарбоновая кислота)
NH Производное пролина. Является иминокислотой, содержится в белках клеточных оболочек, характерен для некоторых фибриллярных белков животного организма (коллаген, эластин) и для растительных белков (например, экстенсин – белок, цементирующий целлюлозные волокна растений). Раздел 3. Белки. Пептиды Белки, или протеины, или протеиды (от греч. рrotos – первый, главный) – азотсодержащие биоорганические полимеры, имеющие сложную структурную организацию и состоящие из a-аминокислотных остатков, которые соединены между собой с помощью пептидной связи. Впервые белок (клейковина) был выделен Я. Беккари из пшеничной муки в 1728 г. Эта считается годом зарождения химии белка. В 1762 г. впервые началась работа по изучению белка молока – казеина (А. Халлер). Белки подразделяются на: протеины – простые белки и протеиды – сложные белки. В живой природе существует 1010 – 1212 видов белков, в человеческом организме – 5 × 106, в кишечной палочке – 3 × 103. |


 –CН2–СН–СООН
–CН2–СН–СООН NH2
NH2 –CH2–CH–COOH
–CH2–CH–COOH NH2
NH2 b a
b a
 –CH2–CH–COOH
–CH2–CH–COOH
 |
|

 N – CH2 – CH – COOH
N – CH2 – CH – COOH H2C CH2
H2C CH2
 HOHC CH2
HOHC CH2
 H2C CH–COOH
H2C CH–COOH